10月8日,辉瑞/OPKO Health宣布在3~18岁生长激素缺乏(GHD)儿科患者中开展的评估每周1次注射somatrogon的随机化、开放标签、交叉用药、III期C0311002研究取得成功。
C0311002 研究共入组87例3~18岁患者,完成12周治疗周期后交叉用药,43例患者先接受每日1次注射somatropin 后接受每周11次注射somatrogon,44例患者先接受somatrogon后接受somatropin。研究的主要终点是接受12周治疗的治疗负担改善(采用总体生活干预评分进行评估)。
顶线数据显示,治疗12周后,每周1次注射somatrogon组患者的平均总体生活干预评分显著低于每日1次注射somatropin组(8.63 vs 24.13),显著改善患者的治疗负担。另外,在关键次要终点指标方面,每周1次注射somatrogon组患者的总体治疗获益也有显著提高。
安全性方面,在每个治疗阶段都未发现严重不良事件,1例接受somatrogon治疗的患者因为非严重的治疗相关紧急不良事件(TEAEs)终止治疗。两组的TEAEs均未轻至中度且具有可比性。
辉瑞全球罕见病产品开发负责人Brenda Cooperstone表示:“我们对于somatrogon在临床研究中显示的治疗获益感到兴奋,如果somatrogon获得批准,可以减少对患者日常生活的治疗干预,相比每日1次注射生长激素大大提高了依从性。生长激素缺乏患者长达40年来都必须忍受每日1次注射的治疗负担,我们希望通过提供每周1次注射的长效生长激素来改善当前临床上GHD的治疗标准。”
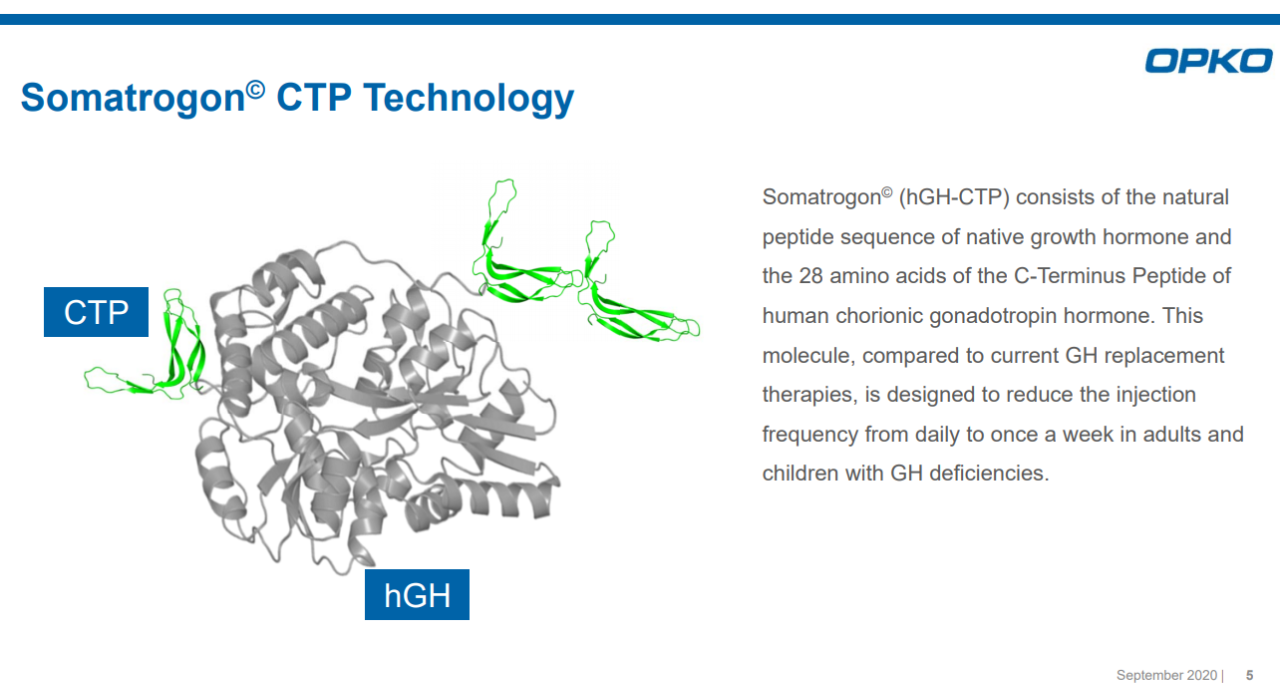
Somatrogon是基于OPKO专有的C末端肽段(CTP)长效技术构成的新分子实体,是在天然生长激素的N末端添加了1个来自人类绒毛膜促性腺激素(HCG)β亚基的CTP拷贝,在C末端添加了2个上述CTP拷贝,达到延长生长激素半衰期的结果。Somatrogon在美国和欧盟均获得了用于治疗儿童和成人生长激素缺乏症的“孤儿药”资格。
2014年,辉瑞与OPKO达成关于 somatrogon治疗GHD的全球开发和商业化合作。根据协议条款,辉瑞负责somatrogon的临床开发、注册和商业化推广。去年10月,辉瑞/OPKO Health曾宣布每周1次注射somatrogon针对青春期前儿童生长激素缺乏症的III期研究取得非劣于每日1次注射somatropin的顶线结果。双方还将进一步评估somatrogon用于其他儿科和成人适应症的潜力。
生长激素缺乏症是一种罕见病,其特征在于垂体前叶腺分泌的生长激素不足,影响约1/4000~10000人。在儿童中,这种疾病可能是先天性基因突变引起的,也可能后天获得的。由于患儿体内生长激素水平不足,可能会影响其身高,造成青春期延迟,还可能存在代谢异常、社会心理障碍、认知缺陷。。如果不进行干预治疗,患者成年后身高会非常矮,并且可能会遇到其他健康问题。
生长激素缺乏症患者可以接受注射生长激素作为替代疗法,但是数十年以来,生长激素缺乏儿童的常规治疗方法是每日一次生长激素皮下注射,用于改善身高和代谢异常。对于患者和其照护者而言,每日1次注射治疗的负担较重,导致依从性不佳和总体治疗效果下降。
9月1日,FDA批准诺和诺德开发的Sogroya(somapacitan)上市,用于治疗成人生长激素缺乏症。Sogroya是FDA批准的首款长效人生长激素,成人患者仅需每周1次皮下注射给药。今年6月26日,Ascendis药业向FDA提交了每周1次TransCon™人生长激素用于治疗儿童生长激素缺乏症(PGHD)的上市申请。







