文 | 黎元
胰腺导管腺癌(PDA)是最常见的一种胰腺癌,致死率高,预后极差。治疗PDA一直是临床研究中的一项极具难度的挑战。有学者预测,随着PDA发病率的持续上升和死亡率的极小变化,到2030年,PDA将成为癌症相关死亡的第二大原因。
只有少数可切除PDA患者能通过手术和辅助化疗实现长期生存。PDA几乎对FDA批准的免疫疗法具有完全的耐药性,这些免疫疗法在黑色素瘤和肺癌等实体瘤晚期患者中一路斩妖除魔,但却在PDA这座大山上几乎屡战屡败。
12月14号,在Cancer Cell的一篇综述中,美国宾夕法尼亚大学Perelman医学院的研究人员对PDA在研的新型免疫疗法进行了回顾,并讨论了未来有希望的治疗策略。
肿瘤内在的免疫抵抗机制
PDA对免疫疗法的耐药性是由其独特的基因图谱驱动的。KC和KPC小鼠这类PDA基因工程小鼠模型极大地增强了我们对PDA肿瘤发生的理解,并有助于临床前免疫治疗药物的发现。例如,研究人员利用这些小鼠模型定义了胰腺导管上皮内瘤变(PanIN)是由突变的KRAS(mKRAS)所启动,并在肿瘤抑制基因失活后发展为侵袭性癌症。
对人类PDA外显子组的研究已经验证了KRAS激活突变表达的高度普遍性。等位基因不平衡(allelic imbalance)导致mKRAS基因表达的增加可能是PDA进展和转移的关键决定因素。尽管与其它类型的癌症有共同的致癌通路,但PDA是一种具有不同临床表型的遗传异质性疾病,遗传和表观遗传变化赋予了它与众不同的分子、细胞和临床特征。
图1显示了由mKRAS下游信号传导所形成的免疫抑制网络。越来越多的研究证据表明,mKRAS除了具有经典致癌作用外,还驱动着TME内免疫抑制的建立。mKRAS通过增强自噬作用来调节细胞表面主要组织相容性复合体I类(MHC-I)的水平,并通过调节CD47和PD-L1的表达,直接阻止先天性和适应性抗肿瘤免疫。
此外,mKRAS可协调旁分泌网络,建立由免疫抑制性细胞、活化的基质细胞和结缔组织增生组成的TME,而且TME进化发生在侵袭性癌症形成之前。在KC小鼠中可观察到,PanIN病灶被免疫抑制性肿瘤相关巨噬细胞(TAM)、髓系来源抑制细胞(MDSC)和调节性T细胞(Treg)所浸润。
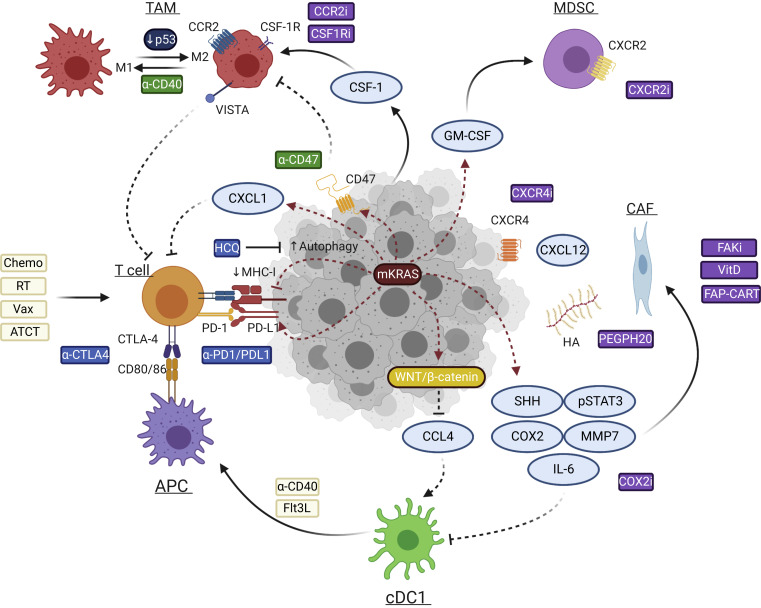
PDA的免疫抵抗(来源:Cancer Cell)
靶向mKRAS信号传导可能会促进抗肿瘤免疫应答。在工程化CT-26小鼠肿瘤模型中,抑制KRAS G12C增加了肿瘤细胞MHC-I的表达,并促进T细胞对TME的浸润,增加了肿瘤对免疫调节的敏感性。然而,KRAS G12C突变在PDA中很罕见,其它更普遍的mKRAS变异也没有靶向疗法,但在工程外泌体和mKRAS特异性T细胞等替代性疗法领域进行的研究已显示出了有希望的结果,未来有望造福PDA患者。
PDA对免疫检查点阻断的原发性耐药
靶向CTLA-4或PD-1/L1的免疫检查点阻断疗法,无论是单药还是联合用药,在晚期PDA中的治疗活性均有限。原因可能是体内缺乏强劲的预存T细胞免疫。在初次治疗的PDA患者中,自然发生的T细胞应答是有限的。限制PDA中自然发生的T细胞免疫的因素有MHC-I的低表达和TME介导的T细胞启动和功能的抑制等。
利用联合疗法赋予抗原特异性、增强T细胞功能和肿瘤识别能力可能会增加PDA对免疫检查点阻断疗法的敏感性(图1)。在临床前模型中,利用自噬抑制来恢复肿瘤细胞MHC-I表达或利用CD40单抗激发肿瘤特异性T细胞免疫能增强PDA对免疫检查点阻断疗法的应答。
PDA的抗原强度
PDA肿瘤的抗原强度决定着肿瘤的免疫应答强度,PDA的抗原表达强度较低。在没有强抗原的情况下,KPC小鼠模型中观察不到显著的免疫监视和免疫编辑。
在肿瘤发生过程中发生非同义突变会产生肿瘤细胞特异性表达的新抗原。人类PDA肿瘤表达适度的非同义新抗原突变负担,并与患者生存率相关。通常,新抗原很少在患者之间共享,这限制着新抗原靶向疗法的开发,所以PDA患者可能需要更加耗时和更加昂贵的个性化疗法。
肿瘤抗原mKRAS
理想的靶抗原应由肿瘤细胞特异性表达,且对肿瘤发病机制至关重要。在PDA中,癌症驱动基因的体细胞突变符合这些标准。90%以上的人类PDA中发生KRAS的非同义突变,突变位点几乎都是G12密码子。TP53失活发生在∼70%的PDA病例中。长期以来,癌症疫苗的研究中一直在探索着将突变的KRAS和p53作为治疗靶点。虽然部分患者在接受靶向疗法后可能会被诱导出对mKRAS和p53的T细胞应答,但大多数研究都不足以证明靶向mKRAS和p53的临床益处,也无法明确定义人类白细胞抗原(HLA)限制性免疫原性表位。
近期一项在HLA转基因小鼠模型中的研究表明,mKRAS的免疫靶向可能适用于特定HLA类型的患者。因此,想要推进疗法的广泛临床应用,还需要更好地了解mKRAS抗原加工和呈递以及抗原表位-HLA的结合特性。
激发PDA特异性免疫
化疗、放疗和先天性免疫的激活
模式识别受体,如toll样受体(TLR)和环GMP-AMP合成酶(cGAS)在先天免疫细胞表面表达,能检测识别病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP),促使炎性细胞因子和I型干扰素(IFN)的表达,激活适应性抗肿瘤免疫。有研究证据表明,化疗和放疗通过释放PAMP和DAMP促进TLR依赖性和干扰素基因刺激物(STING)依赖性树突状细胞的激活,使肿瘤对免疫检查点阻断疗法产生敏感性。
化疗和放疗的肿瘤杀伤活性能与免疫疗法协同作用,通过增加MHC-I的表达、抗原交叉呈递和T细胞启动,来扩大TCR库,增强T细胞对肿瘤的浸润。在PDA临床试验中,将化疗或放疗与免疫治疗联合治疗也正在积极进行(表1)。
表1 部分基于免疫疗法的PDA临床试验
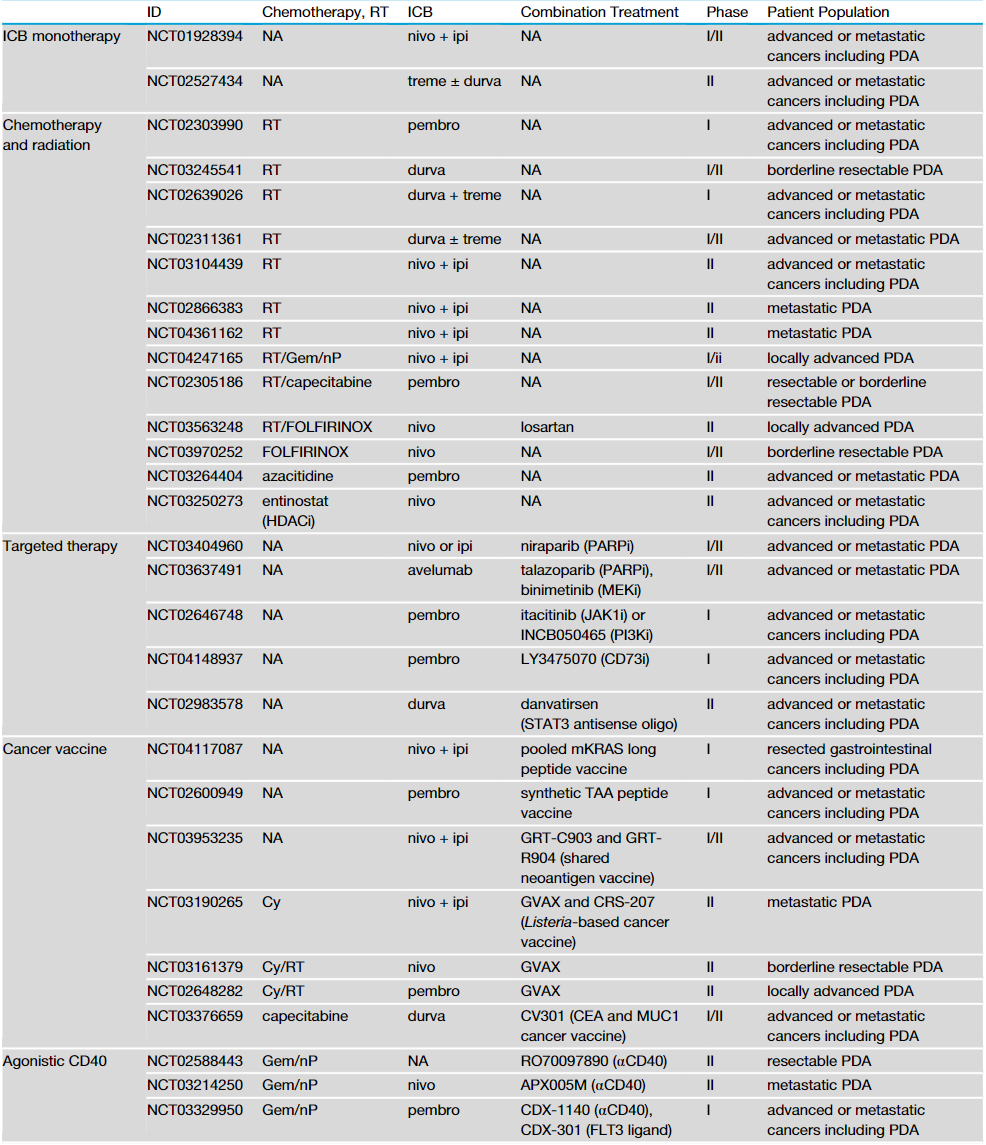
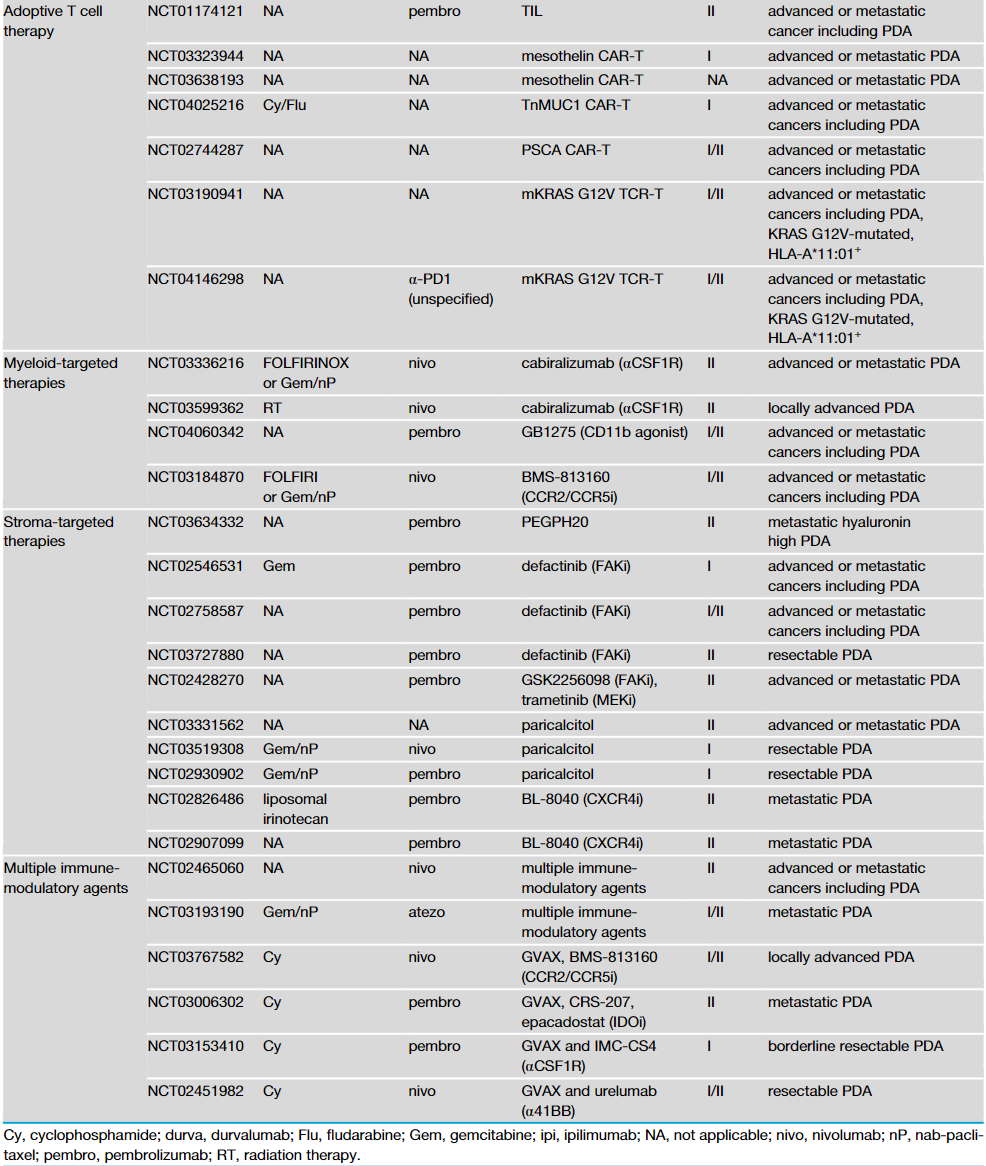
来源:Cancer Cell
癌症疫苗
癌症疫苗是一种新型免疫治疗方式。靶向mKRAS、癌胚抗原(CEA)、粘蛋白1(MUC1)和端粒酶等的早期研究表明,癌症疫苗能诱导抗原特异性免疫,延长免疫应答者的生存期。然而,在几项靶向端粒酶或EGFR2的验证性疫苗试验中,尽管疫苗诱导了T细胞免疫,但未能证明对晚期PDA患者的临床益处。
疫苗是一种辅助疗法,在肿瘤负担和TME免疫抑制最小化的环境下,有望提高临床疗效。在PDA患者中进行的mKRAS佐剂肽疫苗研究在大多数患者中引起免疫应答,且与生存率的改善有关。接种疫苗可能提高肿瘤对免疫检查点阻断疗法的敏感性,与单独使用任一疗法相比,疫苗/免疫检查点阻断联合治疗可促进T细胞浸润肿瘤并克服T细胞耗竭,诱导持久的肿瘤消退。
过继性T细胞疗法
T细胞浸润与PDA临床结果改善之间具有相关性,PDA肿瘤被不同程度的CD4+和CD8+T细胞浸润,这些细胞往往驻留在肿瘤核心外的基质区域内。临床前研究已经证明了从PDA肿瘤标本中分离和体外扩增肿瘤浸润淋巴细胞(TIL)的可行性。然而,大多数PDA患者缺乏预存T细胞免疫,这可能限制了TIL疗法在PDA患者群体中的适用性。
CAR-T细胞疗法和TCR-T细胞疗法为血液恶性肿瘤患者带来了前所未有的临床变革。然而,这类过继性T细胞疗法在实体瘤领域的成功率却比较低。研究学者们正通过联合免疫调节剂或表达转基因来增强T细胞的归巢、渗透和持久性,提高这类疗法在实体瘤中的活性。此外,也有通过CRISPR/Cas9技术进行基因编辑,实现转基因受体的表达增加或使抑制性信号分子的缺失来增强过继性T细胞疗法的抗肿瘤活性。
在PDA上应用CAR-T和TCR-T细胞疗法的主要限制是抗原的选择。迄今为止,大多数研究都以肿瘤相关抗原(TAA)为靶点,TAA在肿瘤细胞上的表达的可变性或异质性可能会带来更大的脱靶毒性风险。
正在PDA中研究的CAR-T疗法所靶向的抗原靶点有间皮素、前列腺干细胞抗原、癌胚抗原(CEA)、粘蛋白1(MUC1)和人表皮生长因子受体2(HER2)等。在接受靶向HER2和CEA的T细胞产品治疗的患者中曾发生过严重的不良事件,限制了这些抗原在CAR-T治疗PDA中的评估。不过,靶向间皮素的CAR-T在临床前小鼠模型中表现出了疗效,在化疗难治性转移PDA患者的早期临床研究中表现出了安全性,值得继续进行临床评估(表1)。
mKRAS在PDA中的高度表达和保守性突变特征为开发具有广泛普适性的新抗原靶向TCR疗法提供了独特的机会。靶向mKRAS新抗原的过继性T细胞疗法的治疗潜力已被报告,进一步的临床试验研究正在进行中(表1)。
靶向髓系细胞
髓系细胞是TME的主要组成部分,由TAM、多形核MDSC和单核MDSC组成,这些细胞在TME中发挥着免疫抑制作用,对肿瘤的发生和免疫逃逸至关重要。
阻断集落刺激因子-1受体(CSF-1R)可重编程TAM,促进抗原呈递和抗肿瘤T细胞应答的启动,而且CSF-1R阻断和免疫检查点阻断疗法联合可大大增强抗肿瘤活性。然而,一项在晚期PDA患者中评估CSF-1R单抗cabiralizumab与纳武利尤单抗和化疗联合治疗疗效的临床II期研究与单独化疗相比并没有改善无进展生存期(NCT03336216)(表1)。
此外,淋巴细胞的细胞溶解活性与PDA中多种免疫检查点基因的表达相关,包括CTLA4、TIGIT、TIM3和VISTA。其中,VISTA在TAM上表达,并在PDA中富集,与PDA对免疫疗法的耐药性有关,抑制VISTA可能会改善PDA对TAM靶向疗法的应答。
值得一提的是,PDA肿瘤的非致癌通路也介导髓系细胞的浸润,如环氧合酶-2(COX2)能促进趋化因子CXCL1等因子的表达,建立一个"冷"的TME,COX2抑制已被证明在临床中具有可行性。该综述的作者推测"髓系免疫抑制"是PDA中占主导地位的免疫检查点。
靶向基质成分
透明质酸是PDA基质的主要成分,通过透明质酸酶PEGPH20对透明质酸进行酶解,可降低KPC小鼠的间质液压力,增强化疗疗效。其他潜力基质靶点包括黏着斑激酶(FAK)、维生素D受体(VDR)和成纤维细胞活化蛋白(FAP)的过度激活。
PDA中的FAK会促进TME的纤维化和免疫抑制。FAK抑制剂联合PD-1-抗体的早期临床试验正在进行中(表1)。给予维生素D类似物可诱导KPC小鼠的基质重塑并增强化疗反应性,维生素D缺乏与PDA的生存率下降有关,将维生素D类似物与免疫检查点阻断疗法相结合的临床研究正在进行(表1)。FAP在肿瘤细胞和基质成纤维细胞中过度表达,与PDA的不良结局相关。在肺癌和PDA的小鼠模型中敲除FAP表达可提高肿瘤对疫苗和免疫检查点阻断的反应性,这凸显了FAP表达细胞的免疫抑制作用。靶向FAP的CAR-T疗法在包括KPC小鼠在内的癌症小鼠模型中也表现出了抗肿瘤活性。
结语
在PDA肿瘤起始的最早阶段,癌症驱动因子就会促进免疫抑制,减少T细胞浸润。截至目前,化疗、放疗和疫苗等与免疫检查点阻断疗法的联用都没有成功。虽然CAR-T和TCR-T疗法在PDA中的活性仍未得到证实,但对可靶向的PDA抗原(如mKRAS)理解的进展,促进了有希望的过继性T细胞疗法的发展。
免疫单药疗法不太可能在PDA中表现出活性,合理的联合疗法需要:(1)赋予T细胞抗原特异性,(2)增强T细胞效应器功能,(3)中和TME内的免疫抑制性髓系细胞和基质成分,而且应根据PDA基因型特征选择合适的疗法。
最后,mKRAS是很有研究价值的靶点。将来mKRAS很可能成为癌症疫苗和过继性T细胞疗法的可用靶点,而且像MEK抑制剂这种阻断KRAS信号传导的靶向疗法或自噬表型的靶向疗法的开发已经十分火热,并可能与免疫疗法进一步协同,在PDA领域有所作为。







