内容来源:医药观澜
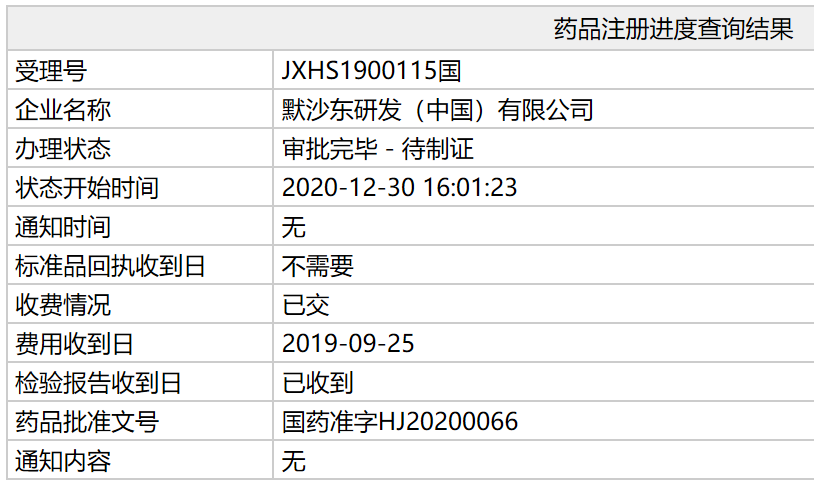
中国国家药监局(NMPA)官网最新公示,默沙东(MSD)公司开发的艾滋病病毒(HIV)感染治疗药物多拉韦林拉米夫定替诺福韦片的上市申请办理状态已更新为“审批完毕-待制证”,药品批准文号为:国药准字HJ20200066。这意味着这款新药已经在中国获批。
根据NMPA药品审评中心(CDE)早前公示,该申请适应症为:适用于治疗HIV-1感染且无NNRTI(非核苷逆转录酶抑制剂)类药物拉米夫定或替诺福韦耐药性的既往或现有证据的成年患者。值得一提的是,此前该三合一HIV新药(英文商品名:Delstrigo)已在美国获批用于治疗未接受过抗病毒疗法的成年HIV-1感染患者。
截图来源:NMPA官网
多拉韦林拉米夫定替诺福韦片是由多拉韦林100mg,拉米夫定300mg,以及富马酸替诺福韦二吡呋酯300mg组合形成的固定剂量复方制剂。其中,拉米夫定(lamivudine)和替诺福韦(tenofovir)均是一种核苷类逆转录酶抑制剂,通过阻断HIV逆转录酶和乙型肝炎病毒聚合酶发挥作用。
另一重要成分多拉韦林(doravirine)是由默沙东公司开发的一种每日一次的口服创新非核苷逆转录酶抑制剂。它通过与HIV-1病毒的逆转录酶结合,防止HIV-1病毒将RNA转化为DNA,从而阻断HIV-1病毒复制。该药已于今年11月下旬在中国获批上市,用于与其他抗反转录病毒药物联合治疗HIV-1感染且无NNRTI类耐药的既往或现有证据的成年患者。
2019年9月,默沙东在中国递交多拉韦林拉米夫定替诺福韦片上市申请并获得CDE受理,该申请随后被纳入优先审评。该三合一疗法在抗HIV感染中的临床效果,此前已在一项名为DRIVE-AHEAD的多中心,含活性对照,关键性随机双盲临床3期试验中得以验证。

截图来源:CDE官网
在DRIVE-AHEAD研究中,728名未接受过抗病毒疗法的HIV-1患者随机接受多拉韦林三合一疗法(试验组),或者依非韦伦/恩曲他滨/替诺福韦组合疗法(对照组)的治疗。结果显示,多拉韦林三合一疗法表现出持续48周的病毒抑制,并且与对照组相比达到了非劣效性的主要终点。试验组84%的患者将HIV-1病毒RNA拷贝数抑制到<50拷贝/毫升(vs 81%)。对于那些基线病毒载量高的患者,接受多拉韦林三合一疗法的患者达到病毒抑制的比例为77%(vs 74%)。
在安全性方面,试验组因不良事件而终止治疗的比率低于对照组(分别为3%和6%)。临床常见的不良反应包括头晕(7%),恶心(5%)和异梦(5%)。在接受多拉韦林三合一疗法治疗的参与者中,超过2%的受试者没有发生2级及以上(中度或严重)的不良反应。

该研究数据证实了多拉韦林拉米夫定替诺福韦片对于HIV-1患者的疗效和安全性。根据默沙东早前发布的新闻稿描述,多拉韦林拉米夫定替诺福韦片的批准为未接受过适当治疗的HIV-1成年患者提供了一种新选择。此外,这种复方制剂还可以与多种非抗逆转录病毒药物共同给药。
艾滋病是由于HIV感染引起的严重疾病,曾经被认为是无药可治的致命疾病。然而在上世纪末,随着鸡尾酒疗法的建立,艾滋病已经成为可控的慢性疾病。尽管目前的疗法还不能够完全治愈HIV感染,但可以显著降低患者体内病毒数量,维持患者免疫功能,并且防止HIV病毒传播。通过抗病毒疗法的治疗,艾滋病患者能够达到与普通人相当的预期寿命。
我们祝贺默沙东多拉韦林拉米夫定替诺福韦片正式在中国获批上市,希望该产品能让更多HIV感染的患者获益。







