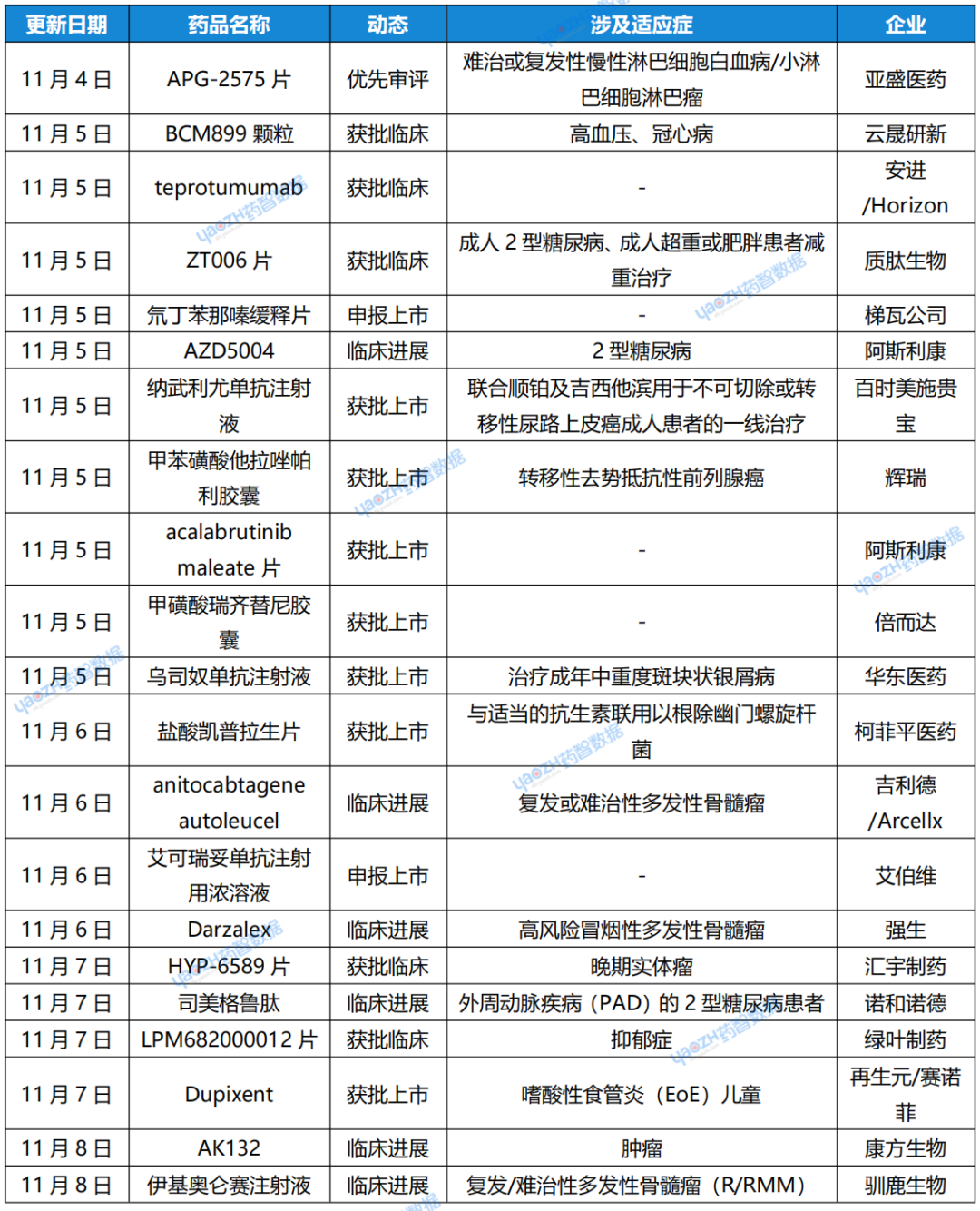
药智数据精选上周(11月4日~11月10日)新药研发领域最新动态,包括新药研发进展、重磅药品交易等信息,一文速览。
图片资料来源:药智数据企业版——全球药物分析系统数据库、各企业官网
更多全球新药最新进展及详细信息,欢迎前往药智数据——全球药物分析系统订阅与查看~
绿叶制药:
LPM682000012片
11月7日,据CDE官网显示,绿叶制药的1类新药LPM682000012片获得临床试验默示许可,适应症为抑郁症。
图片来源:CDE官网
世卫组织于2017年发布的一则报告曾提到,全球约有3.22亿人罹患抑郁症;据《2022年国民抑郁症蓝皮书》显示,我国抑郁症患病人数高达9500万,但治疗率仅为9.5%。随着社会压力增大,越来越多人出现心理健康问题,抑郁症患者人数不断增多,抗抑郁药物需求持续增大。据Grand View Research预测,2028年全球抗抑郁药物市场规模将达到600亿美元。
当前,尽管临床上已有许多抗抑郁药物可供选择,但大多数药物仍然存在起效慢、效率不高、甚至导致性功能障碍和认知损伤等缺陷。因此,患者们仍然需要更多新型、有效的抗抑郁药物。
LPM682000012是绿叶制药申报的一款1类新药,本次获批开展临床试验的适应症为抑郁症。此外,绿叶制药还有一款1类创新药“盐酸托鲁地文拉法辛”(LY03005)已在国内获批治疗抑郁症,该药物还正被开发用于治疗广泛性焦虑障碍。
LPM682000012作为绿叶制药在抗抑郁领域布局的另一款创新药物,有望为抑郁治疗带来新方式。
其他新药研发进展
1.亚盛医药「APG-2575片」拟优先审评
11月4日,据CDE官网显示,亚盛医药的1类新药APG-2575片拟优先审评,拟针对难治或复发性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者。APG-2575 是亚盛医药自主研发的一款Bcl-2选择性抑制剂,可通过选择性抑制 Bcl-2 蛋白,恢复癌细胞的正常凋亡过程,从而达到治疗肿瘤的目的。据了解,APG-2575是首个在中国进入临床阶段的、本土研发的Bcl-2抑制剂,也是全球第二个、国内首个看到明确疗效、并进入关键注册临床阶段的Bcl-2抑制剂。
2.云晟研新「BCM899颗粒」获批临床
11月5日,据CDE官网显示,云晟研新的2.2类新药BCM899颗粒获得临床试验默示许可,适应症为高血压、冠心病。据公开资料显示,BCM899颗粒是含有已知活性成分的新剂型,改良后的颗粒剂型有望提高老年、儿童等有服药/吞咽困难患者的服药依从性,从而为其提供新选择。该品种其他剂型的销售金额已达数十亿元,剂型改良后其竞争力将进一步加强,从而占据更大的市场份额。
3.安进/Horizon公司「teprotumumab」在华申报临床
11月5日,据CDE官网显示,由Horizon Therapeutics和安进共同申报的teprotumumab的新药临床试验申请获得受理。据公开资料显示,这是一款“first-in-class”靶向IGF-1R的单抗,也是首款获得美国FDA批准治疗甲状腺眼病的创新疗法。2023年10月,安进以总价值278亿美元完成对Horizon公司的收购,从而获得该产品。
4.质肽生物「ZT006」获批临床
11月5日,据CDE官网显示,质肽生物的1类新药ZT006片获得临床试验默示许可,拟开发用于成人2型糖尿病患者的血糖控制;7日,其针对成人超重或肥胖患者减重治疗的临床试验申请也获得批准。据公开资料显示,ZT006 是一种新一代口服GLP-1药物,具有较高的生物利用度,有希望成为继口服司美格鲁肽之后的新一代口服GLP-1品种。
5.梯瓦公司「氘丁苯那嗪缓释片」在华申报上市
11月5日,据CDE官网显示,梯瓦公司申报的5.1类新药氘丁苯那嗪缓释片的上市申请获得受理。据公开资料显示,氘丁苯那嗪是一款囊泡单胺转运蛋白2(VMAT2)抑制剂丁苯那嗪的氘代药物,此前已经在中国获批治疗亨廷顿舞蹈病和迟发性运动障碍。本次申报的产品是该药物的缓释片新剂型。
6.阿斯利康公布「AZD5004」临床新进展
11月5日,阿斯利康公布了AZD5004在患有2型糖尿病的肥胖患者中进行的1期临床试验的最新结果,AZD5004是一款每日一次、低剂量的小分子GLP-1受体激动剂。数据显示,这款在研疗法在治疗4周后将患者体重减轻5.8%,并且改善患者的血糖指标。
7.百时美施贵宝「纳武利尤单抗注射液」新适应症在华获批
11月5日,百时美施贵宝宣布其纳武利尤单抗注射液(商品名:欧狄沃)获得NMPA批准,联合顺铂及吉西他滨用于不可切除或转移性尿路上皮癌成人患者的一线治疗。据介绍,此次获批后,欧狄沃联合化疗成为了中国首个且目前唯一获批用于晚期尿路上皮癌一线治疗的免疫疗法。目前,该产品的适应症同时覆盖尿路上皮癌早期辅助治疗和晚期一线治疗,有望成为中国尿路上皮癌全病程治疗的基石方案。
8.辉瑞「甲苯磺酸他拉唑帕利胶囊」新适应症在华获批
11月5日,据NMPA官网显示,辉瑞的甲苯磺酸他拉唑帕利胶囊获批上市。据公开资料显示,他拉唑帕利(talazoparib)是一款口服PARP抑制剂,本次在中国获批适应症为转移性去势抵抗性前列腺癌(mCRPC)。据药物临床试验登记与信息公示平台显示,辉瑞已开启了一项他拉唑帕利与恩扎卢胺联合治疗DNA损伤修复(DDR)基因突变mCSPC男性患者的国际多中心(含中国)3期随机研究。
9.阿斯利康「acalabrutinib maleate片」获批上市
11月5日,据NMPA官网显示,阿斯利康申报的acalabrutinib maleate片(马来酸阿可替尼片)上市申请已获得批准。据公开资料显示,阿可替尼是一款BTK抑制剂,通过与BTK共价结合抑制其活性。该产品的胶囊剂型此前已经在中国获批,本次是片剂剂型首次在中国获批上市。
10.倍而达「甲磺酸瑞齐替尼胶囊」新适应症获批
11月5日,据NMPA官网显示,倍而达药业的甲磺酸瑞齐替尼胶囊新适应症上市申请获得批准。据公开资料显示,瑞齐替尼为第三代EGFR TKI小分子药物,其首个适应症已经于2024年5月获NMPA批准上市,用于二线治疗EGFR T790M突变阳性的非小细胞肺癌(NSCLC)成人患者。
11.华东医药「乌司奴单抗注射液」获批上市
11月5日,国家药监局发布药品批准证明文件送达信息,华东医药子公司中美华东申报的乌司奴单抗注射液(赛乐信®)获批上市。据了解,赛乐信®是国内首个获批的乌司奴单抗注射液生物类似药,用于治疗成年中重度斑块状银屑病。原研药在2023年的全球销售额成功突破百亿美元大关,达到了108.58亿美元。
12.柯菲平医药「盐酸凯普拉生片」新适应症获批
11月6日,柯菲平医药宣布其自主研发的1类创新药盐酸凯普拉生片的新适应症获得NMPA批准上市,适应症为:与适当的抗生素联用以根除幽门螺旋杆菌。据报道,这是盐酸凯普拉生片继反流性食管炎(RE)、十二指肠溃疡(DU)后获批的第3项适应症。
13.吉利德/Arcellx公布「anitocabtagene autoleucel」临床新进展
11月6日,吉利德旗下Kite公司与Arcellx宣布2024ASH年会中,公布其联合开发BCMA靶向CAR-T细胞疗法anitocabtagene autoleucel(anito-cel)用于治疗复发或难治性多发性骨髓瘤(RRMM)患者的临床试验最新结果。此前公布的摘要结果显示,接受anito-cel治疗患者的总缓解率(ORR)高达100%,完全缓解/严格完全缓解(CR/sCR)率近80%,且未在患者中观察到某些迟发性神经毒性的案例。
14.艾伯维「艾可瑞妥单抗注射用浓溶液」在华申报上市
11月6日,据CDE官网显示,艾伯维的艾可瑞妥单抗注射用浓溶液新药上市申请获得受理。据公开资料显示,艾可瑞妥单抗是一款CD3/CD20双抗,此前已经获美国FDA批准治疗弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤。据公开资料显示,艾可瑞妥单抗由艾伯维和Genmab公司共同研发,两家公司在美国和日本共同分担商业化责任,艾伯维则负责该产品进一步的全球商业化工作。
15.强生「Darzalex」研究新进展公布
11月6日,强生开发的抗CD38抗体Darzalex(daratumumab)出现在2024 ASH年会公布的部分研究摘要中。该药物在名为Aquila的3期临床试验中达到主要终点,显著延缓高风险冒烟性多发性骨髓瘤(SMM)患者的疾病进展。
16.汇宇制药「HYP-6589片」获批临床
11月7日,据CDE官网显示,汇宇制药的1类新药HYP-6589片获得临床试验默示许可,拟用于治疗晚期实体瘤。据公开资料显示,该药物是一款高选择性SOS1小分子抑制剂。该药物在体外试验中展现出了对不同KRAS突变类型的不同类型肿瘤细胞普遍具有优异的增殖抑制活性;动物体内试验结果显示,HYP-6589在人胰腺癌、人非小细胞肺癌、结直肠癌等模型中具有显著的单药和联用抑瘤效果。
17.再生元/赛诺菲「Dupixent」新适应症在欧盟获批
11月7日,再生元与赛诺菲宣布,其重磅疗法Dupixent获得欧盟批准用于治疗嗜酸性食管炎(EoE)儿童患者。该批准涵盖1至11岁、体重至少15公斤且病情无法充分获得控制、无法耐受或不适合常规药物治疗的儿童。根据新闻稿,Dupixent是在欧盟获批用以治疗此年龄段EoE儿童患者的首个药物。
18.诺和诺德公布「Ozempic」临床新进展
11月7日,诺和诺德在第三季度财报中宣布,Ozempic(semaglutide,司美格鲁肽)用于治疗患有外周动脉疾病(PAD)的2型糖尿病患者的3b期试验达到主要终点。根据此积极结果,诺和诺德预计将于2025年上半年在美国和欧盟递交Ozempic扩展适应症的监管申请。
19.康方生物公布「AK132」研究进展
11月8日,康方生物宣布在2024 年肿瘤免疫治疗学会年会上,首次对外发布其独立自主研发的双特异性抗体新药AK132的药物机制研究成果。临床前结果显示:AK132 对CLDN18.2+/CD47+肿瘤细胞具有ADCC、ADCP和CDC效应,从而具有强大的抗肿瘤效果。且体外实验显示,AK132不引起红细胞凝集、无红细胞毒性,安全性良好。AK132有望成为一种更具临床效益的肿瘤免疫治疗新药。
20.驯鹿生物「伊基奥仑赛注射液」研究新进展见刊于JAMA Oncology
11月8日,驯鹿生物宣布,伊基奥仑赛注射液针对复发/难治性多发性骨髓瘤(R/RMM)的1b/2期临床研究FUMANBA-1结果已发表于国际权威期刊JAMA Oncology。伊基奥仑赛是一款全人源靶向BCMA的CAR-T疗法。该研究评估了伊基奥仑赛注射液在既往接受过3线及以上治疗的R/RMM患者中的有效性和安全性,结果显示伊基奥仑赛注射液在R/RMM患者中表现出高总体缓解率和持久缓解,同时安全性良好。数据显示,治疗总体缓解率(ORR)为96.0%,其中既往未接受过CAR-T治疗受试者ORR为98.9%。
全球药品交易动态
1.维立志博与Aditum Bio成立新公司以推动LBL-051进入临床研究
11月7日,维立志博与风险投资公司Aditum Bio宣布,基于维立志博CD19xBCMAxCD3三特异性T细胞衔接器抗体LBL-051成立新药研发公司Oblenio Bio,并达成了独家选择权及许可协议。Aditum将为Oblenio提供资金,双方将合作迅速推进LBL-051进入临床研究。
更多全球新药最新进展及详细信息,欢迎前往药智数据——全球药物分析系统订阅与查看~







