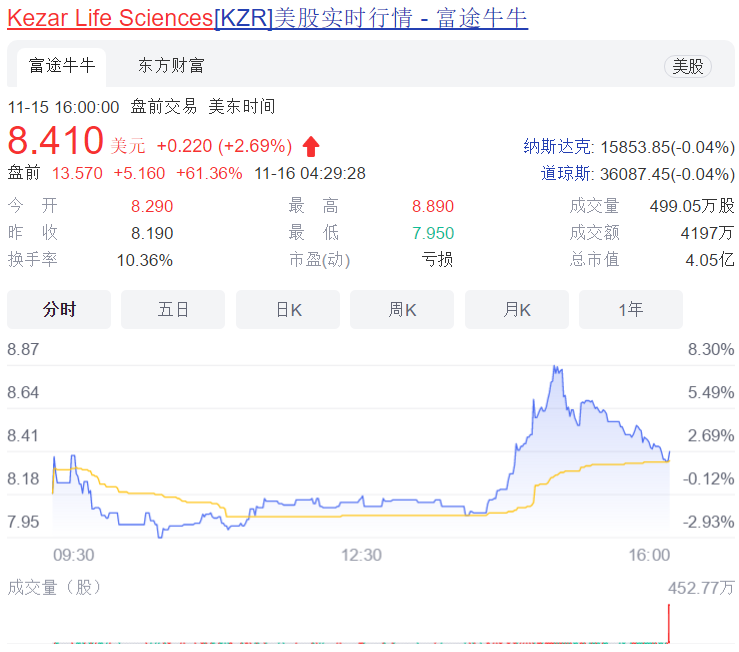
11月15日,Kezar Life Sciences公布了其first-in-class选择性免疫蛋白酶体抑制剂KZR-616用于治疗活动性、增殖性狼疮性肾炎(LN)的MISSION研究II期试验中期结果。受此消息影响,至发稿时该公司股价盘前上涨61%。
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)最严重的并发症之一。大约50%的SLE患者会在最初确诊后的10年内发生LN。LN可使患者进展为终末期肾病和死亡的风险增加。目前批准用于治疗LN的疗法有限,通常的管理方法包括通过诱导治疗以达到缓解和通过长期维持治疗以防止复发。
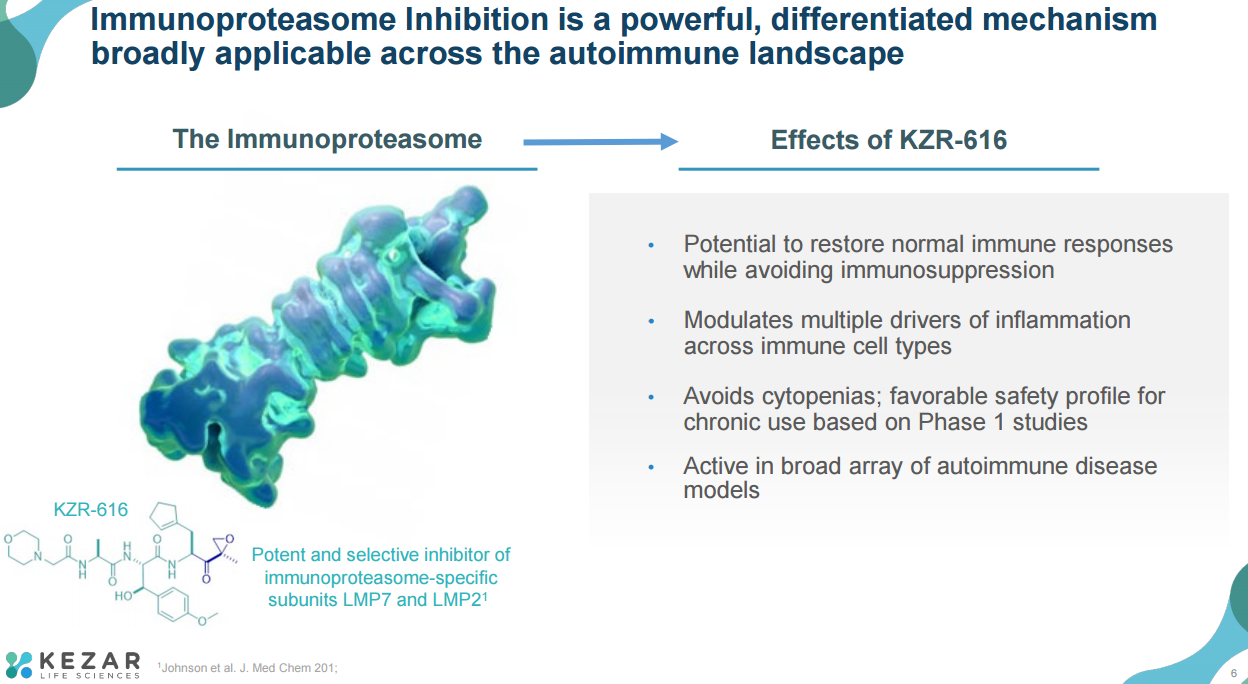
KZR-616是一种新型的、first-in-class、选择性免疫蛋白酶体抑制剂,可调节多种免疫细胞类型的炎症驱动因子,对多种自身免疫性疾病具有广泛的治疗潜力。临床前研究表明,选择性免疫蛋白酶体抑制可在多种自身免疫性疾病的动物模型中产生广泛的抗炎作用,同时避免免疫抑制。
MISSION (NCT03393013)试验是一项Ib/II期临床试验,其开放标签II期试验部分旨在评估KZR-616在活动性狼疮肾炎患者中的应答率。在为期24周的治疗期间,患者在接受背景治疗的基础上每周接受1次皮下注射KZR-616 60mg(首次注射30mg)。在MISSION 试验中,患者不接受KZR-616作为“诱导”治疗的一部分,这与最近发表的其他狼疮性肾炎试验相比有明显差异。
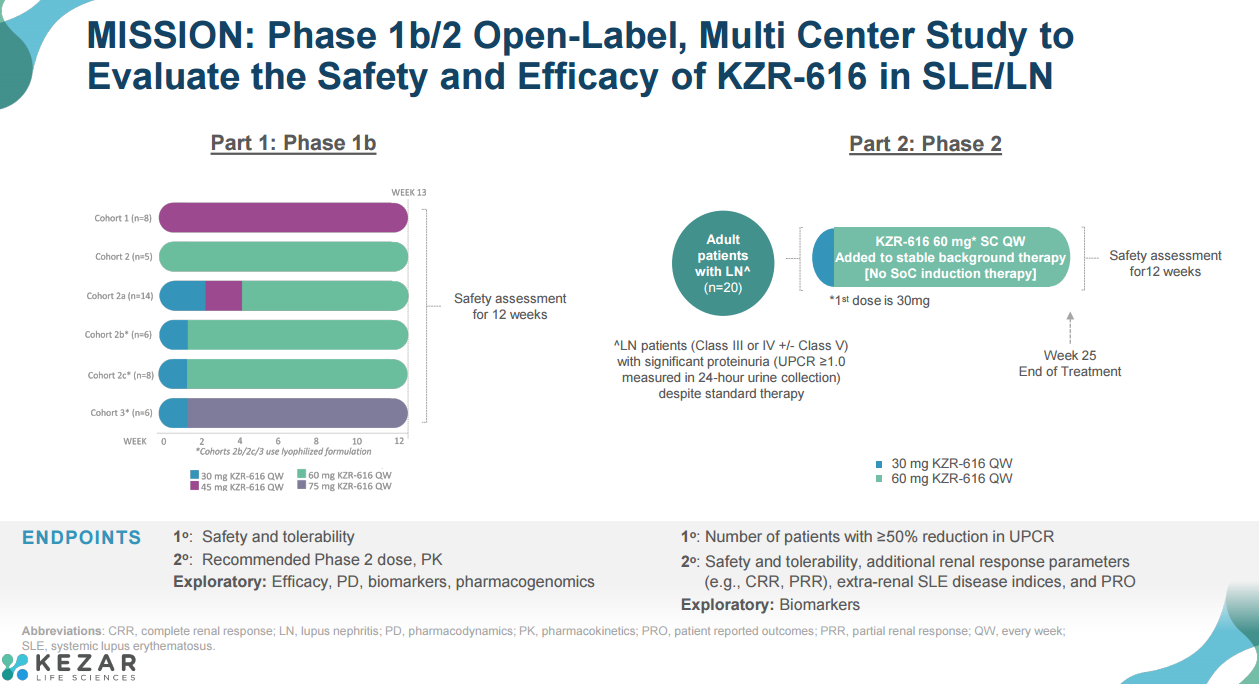
中期分析时,5例患者治疗结束,10例患者已接受治疗13周。试验的主要疗效终点是在治疗结束时,尿蛋白/肌酐比值(UPCR)降低50%或以上,达到肾脏反应的患者比例。次要终点为达到完全肾脏应答(CRR)和部分肾脏应答(PRR)的患者人数。
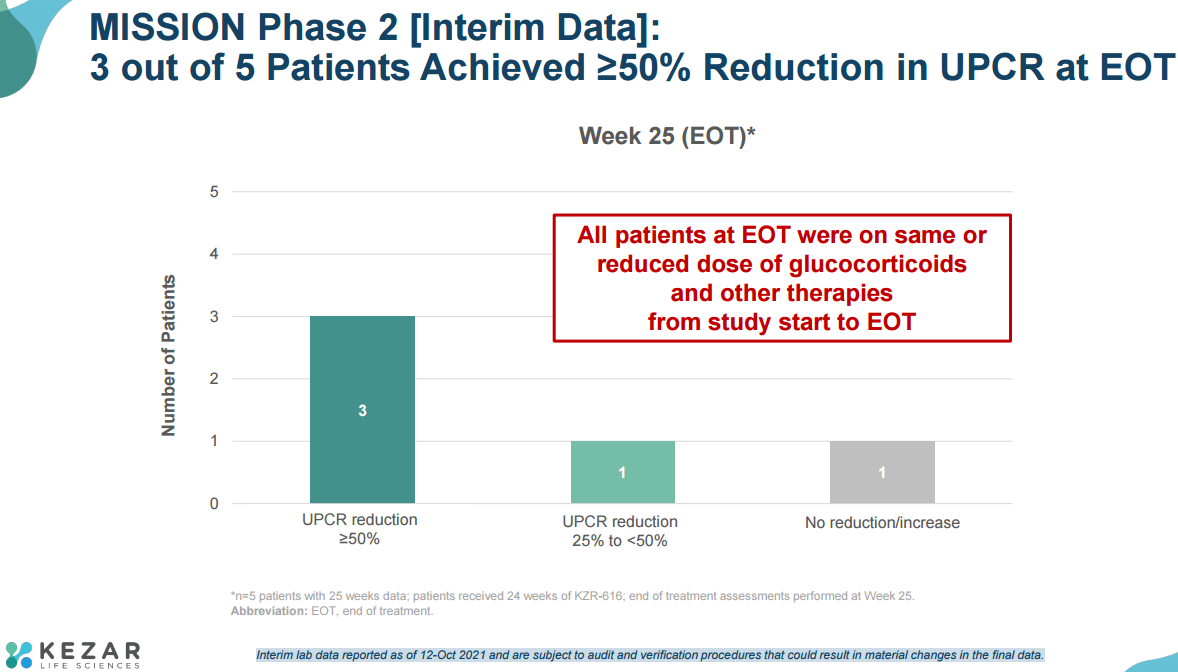
MISSION研究中期分析结果显示,第25周时,5例患者中有3例的UPCR值较基线(主要疗效终点)降低了50% 或更多。5例患者中有4例的蛋白尿降低至0.8 UPCR以下,具有显著临床意义。其中,2例患者出现CRR,且绝对蛋白尿值降低至等于或小于0.5 UPCR。2例患者出现PRR,绝对蛋白尿值降低至0.5 - 0.8 UPCR之间。
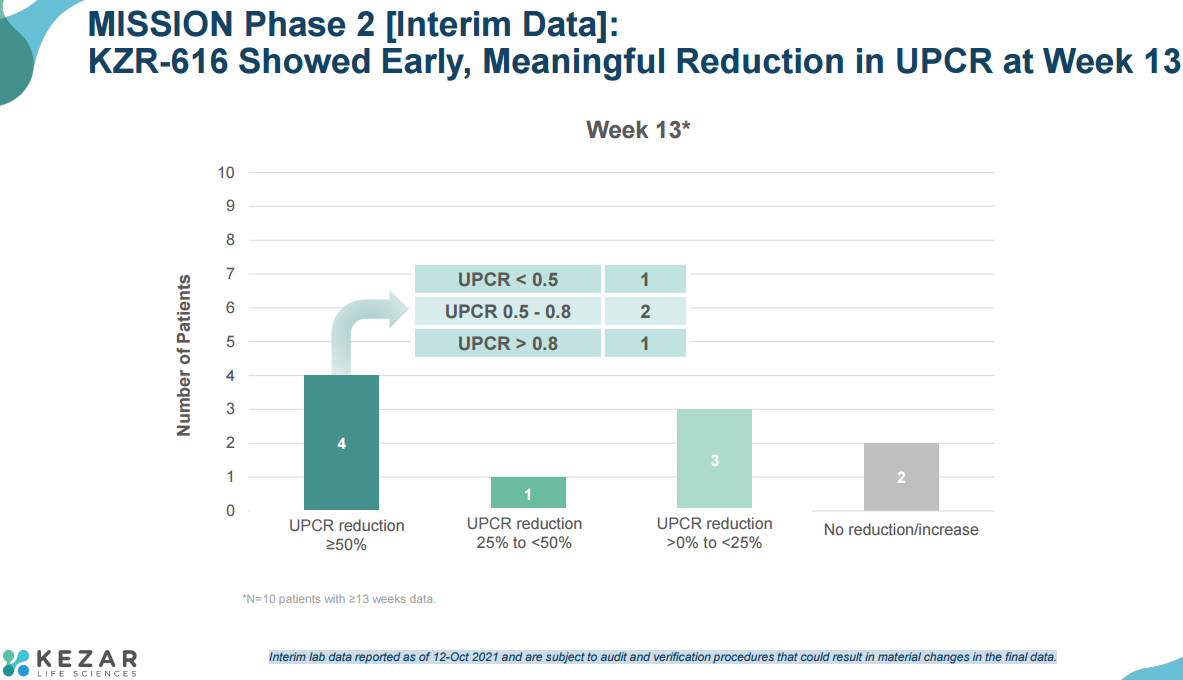
接受KZR-616治疗第13周时,10例患者中有5例的UPCR有临床意义的降低,包括关键疾病生物标志物的改善。
安全性方面,在6个月的治疗期间,KZR-616耐受性良好。MISSION研究的II期部分未观察到新的安全性信号。不良事件一般为轻中度(1或2级)。无受试者因药物相关不良事件而中止研究。有一例患者因3级严重不良事件偏头痛发作而暂时中断治疗。
MISSION研究II期试验部分顶线数据预计将于2022年第二季度公布。
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。







