11月15日,美国生物制药公司Aura Biosciences公布了其首个病毒样药物偶联物(VDC)药物AU-011在不确定性病变(indeterminatelesions,IL)和脉络膜黑色素瘤(choroidalmelanoma,CM)中的临床数据,包括玻璃体(IVT)注射给药的Ⅰb/Ⅱ期安全性和有效性数据,以及加大剂量脉络膜上腔(SC)给药的Ⅱ期安全性结果。
Aura成立于2009年,总部位于美国马萨诸塞州,致力于开发针对眼科肿瘤和泌尿系统肿瘤的靶向疗法。今年3月,Aura获得了Matrix Capital Management领投的8000万美元融资,又于10月29日正式登陆纳斯达克,募资7560万美元,目前市值约5.9亿美元。
Aura基于病毒样颗粒(VLP)的技术平台可使VLP与细胞毒药物共价结合得到VDC,能选择性地结合实体瘤表面的硫酸乙酰肝素蛋白聚糖(HSPG),而不与正常组织结合,从而特异性杀伤肿瘤细胞。该技术平台的开发来源于2017年拉斯克奖获得者John T. Schiller博士的核心发现,他证明源于人乳头瘤病毒(HPV)的VLP能与HSPG特异性结合。
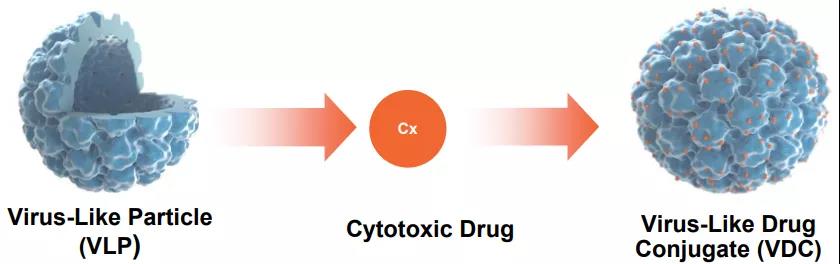
VLP与细胞毒药物偶联得到VDC(来源:Aura官网)
AU-011是Aura管线中进展最快的候选VDC药物,用于CM的一线治疗,已获FDA授予的快速通道和孤儿药资格。AU-011的独特之处在于具有对抗肿瘤的双重作用机制,首先,其偶联的可被红外光激活的强效细胞毒药物可产生高水平的单线态氧,能特异性摧毁肿瘤细胞的细胞膜和细胞器;其次,肿瘤细胞破裂后可暴露新生抗原(neoantigen)并释放损伤相关的分子模式(DAMP),进一步激活免疫细胞产生免疫应答,对肿瘤细胞产生杀伤效果。这种双重作用机制可用于原发性病变的早期治疗,并能防止肿瘤的远端转移。

AU-011杀伤肿瘤的双重作用机制(来源:Aura官网)
AU-011的Ⅰb/Ⅱ期临床试验评估了IVT给药方式治疗IL和CM的安全性和有效性。该试验共纳入56例患者,其中14例肿瘤较小但生长活跃的患者采用2个周期的治疗方案,并以肿瘤生长速度、肿瘤控制和视力保持情况作为疗效终点进行评估。12个月后,结果显示肿瘤生长速率显著降低,肿瘤控制率为64%(9/14),视力保持率为71%,明显优于现有治疗手段。
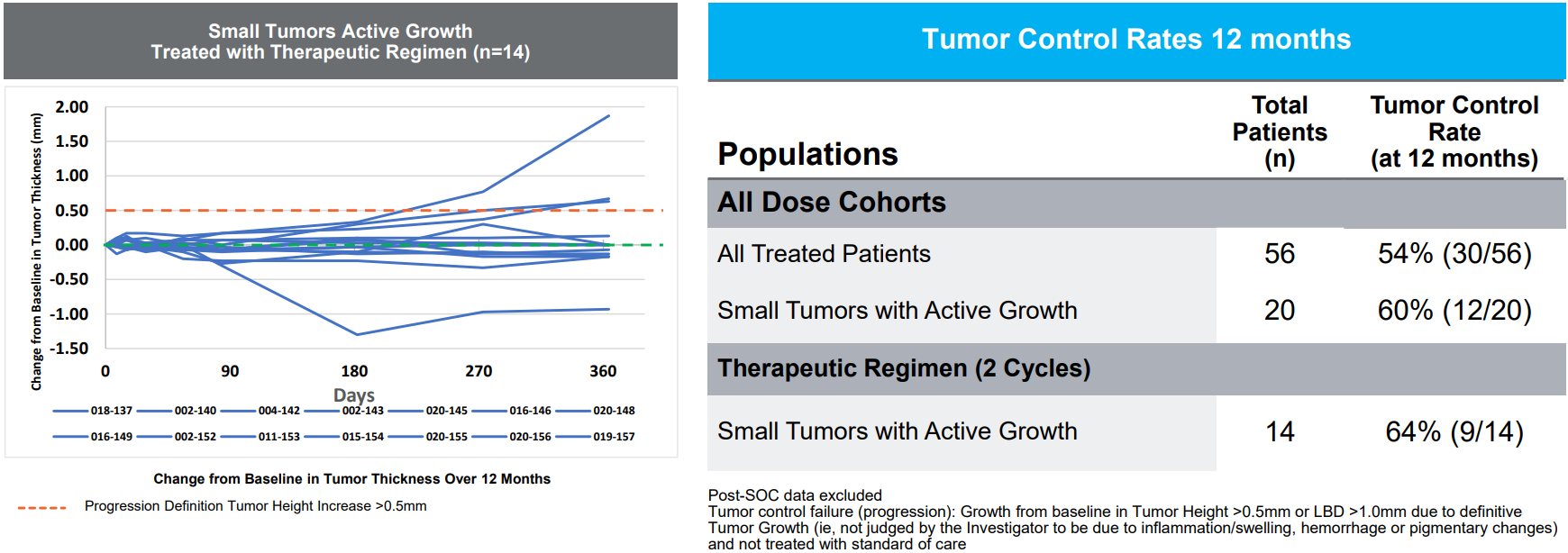
大部分患者的肿瘤得到控制(来源:Aura官网)
安全性方面,AU-011总体安全性和耐受性良好,眼内炎症和眼内高压等不良事件均为暂时性,入组患者无临床后遗症。大量患者(43/56)的肿瘤靠近视网膜的中央凹和视盘,仅有2例肿瘤位于视网膜中央凹的患者出现严重视力丧失不良事件(SAE),未观察到其他与治疗相关的SAE。受此利好消息影响,11月15日收盘Aura股价大涨18.35%。
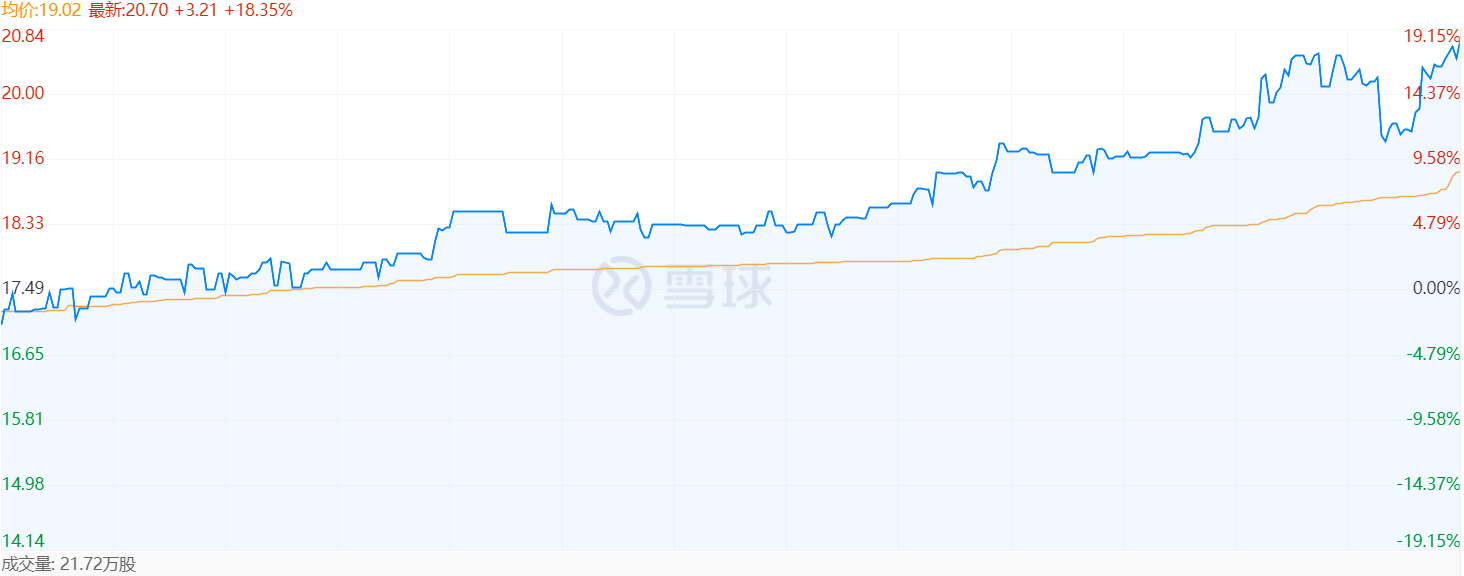
11月15日Aura股价(来源:雪球)
同日,Aura也公布了AU-011 SC给药的Ⅱ期安全性结果。在对初始剂量递增队列(n=14)的初步安全性数据审查中,未报告与治疗相关的不良事件、计量限制性毒性或3/4级不良事件。初步结果表明,通过SC给药方式,AU-011具有积极的安全性和耐受性。
Wills Eye Hospital的眼科肿瘤主任、Thomas Jefferson University眼科教授Carol Shields博士表示相信AU-011会为患者提供一种安全、有效的早期疾病一线治疗手段,并保护视力不受损,这是保证患者生活质量的关键部分。
注:原文有删减







